コラム
アフリカトリパノソーマ症(アフリカ睡眠病)に対する新たな創薬標的の発見
〜GMP還元酵素のトリパノソーマ特異的アロステリック制御機構〜
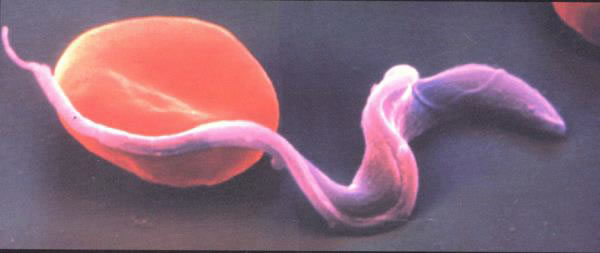
図1.Trypanosoma brucei(手前)と赤血球
(過去の共著論文J. Exp. Med., 192(9), 2000の表紙より転用)
アフリカトリパノソーマ症(アフリカ睡眠病)は,寄生性原虫Trypanosoma brucei(T. brucei,図1)が,ツェツェバエを媒介昆虫として,ヒトや家畜に寄生することによって引き起こされる人獣共通の致死性感染症であり,世界保健機構(WHO)が指定するNeglected Tropical Diseases(顧みられない熱帯病)の1つである。ツェツェバエは吸血性のハエで吸血とともに家畜やヒトの体内にトリパノソーマが感染する。初期は発熱,頭痛,筋肉・関節痛などの軽症状を呈するが,やがて中枢神経系の障害が現れ,錯乱やけいれん発作,歩行困難から,うとうと眠るような症状となり(睡眠病という命名の由来),最後は昏睡状態から死に至る感染症であり,未治療ではほぼ100%が死に至る。アフリカ睡眠病の感染リスクにある人々はサハラ以南のアフリカ36カ国で約6000万人と推定され,年間3万人以上が死亡していると推定されている。家畜においてはナガナ病と呼ばれ年間数十万頭のウシが死亡している。また,シマウマはアフリカ睡眠病に罹りにくいことが知られているが,それはツェツェバエがシマウマの縞模様を避ける習性があることからであり,シマウマはアフリカ睡眠病の感染を避けられるように進化を経て,全身がきれいな縞模様となったという学説が有力である。
さて,この恐ろしいアフリカトリパノソーマ症の治療薬として,現段階ではペンタミジン(プリン受容体を経て寄生虫体内に取り込まれDNAに対する酵素阻害を発揮),スラミン(グリセロリン脂質代謝酵素の阻害やピルビン酸キナーゼ阻害と考えられている),エフロルニチン(オルニチン脱炭酸酵素の阻害と考えられている),メラルソプロール(有機ヒ素)があるが,いずれも重篤な副作用があることや薬剤耐性原虫の出現などの問題が山積しており,新たな作用機序を有する新規治療薬の開発が強く望まれている。
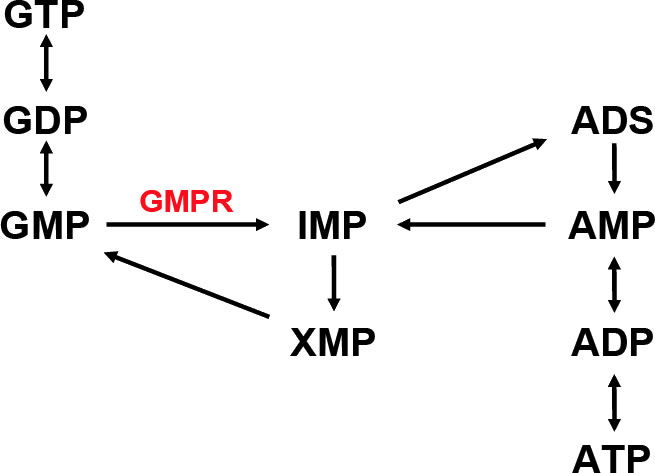
図2.Trypanosoma bruceiにおける
プリンヌクレオチドのサルベージ回路
宿主動物におけるプリンヌクレオチドの合成には,糖やアミノ酸などから新規合成するデノボ経路と,細胞内のプリン塩基と核酸のリサイクルを担うサルベージ経路が存在する。T. bruceiは,プリンヌクレオチドのデノボ合成経路を欠損しているため、宿主から得たヌクレオシドからサルベージ経路(図2)を介してプリンヌクレオチドを合成する。本経路は,グアニンおよびアデニンヌクレオチドの相互変換を行い,これらのヌクレオチドのバランスを保つ重要な働きを持つことから,サルベージ経路中の酵素は創薬標的候補分子になると考えられる。ただし、宿主の酵素とは異なる特性を持つ事がその条件となる。我々が着目したのは、GMP還元酵素(GMPR)である。GMPRはサルベージ経路上の酵素であり,NADPHを補酵素としてGMPからIMPへの脱アミノ化反応を触媒する。この働きは細胞内のGMP濃度の恒常性を維持するために重要であることから,本来,本酵素は進化の過程においても高度に保存されている。しかし,驚くべきことに我々はT. brucei GMPR(TbGMPR)がアロステリック酵素であり,本酵素が有する種特異的構造であるシスタチオニンβ-シンターゼ(CBS)ドメインにグアニンヌクレオチド(GTPおよびGMP),あるいはアデニンヌクレオチド(ATP)が結合することにより,酵素の多量体構造の変化を伴った正および負の活性調節が行われることを明らかにした。具体的には,アポ状態では「弛緩型8量体」であったTbGMPRは,CBSドメインへのGTP/GMPの結合により「ねじれ型8量体」となり活性化し,一方,ATPの結合により8量体構造は崩壊し4量体となって活性が阻害されるというアロステリック制御機構を示す(図3)。
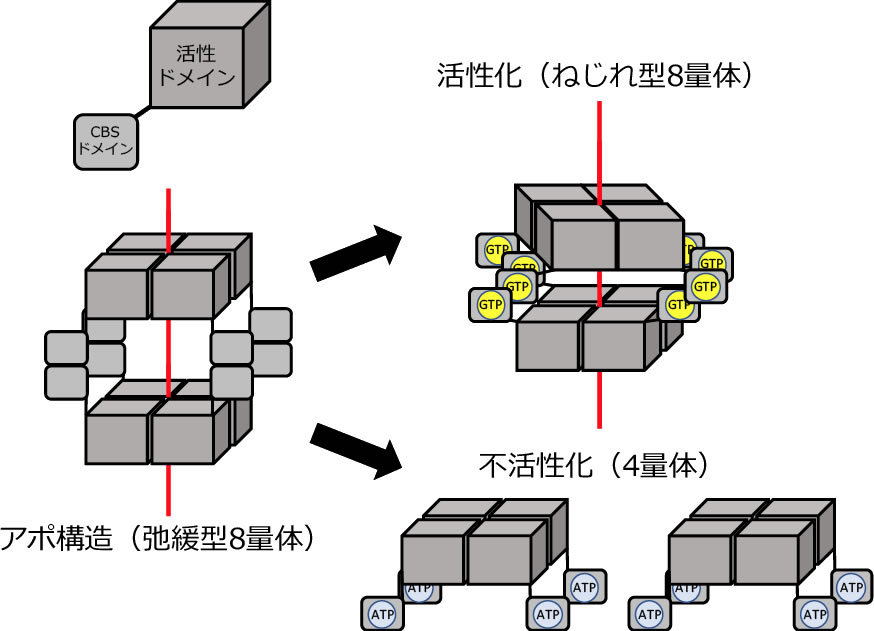
図3.アロステリック制御機構によるTbGMPRの活性調節モデル
以上,種を超えて保存されていると考えられるGMPRが,トリパノソーマにおいては特異なCBSドメインを有しており,これが酵素のON/OFFに重要な役割を担っていることから,今後,CBSドメインを標的にTbGMPRを特異的に阻害するシード化合物を探索し,宿主に対して副作用の発現しない新規アフリカ睡眠病治療薬の開発を目指したい。
参考文献
- Nature Communications 11(1), 1-10, 2020 DOI:10.1038/s41467-020-15611-3
Allosteric regulation accompanied by oligomeric state changes of Trypanosoma brucei GMP reductase through cystathionine-β-synthase domain - 著者:今村 章,岡田哲也,馬瀬ひかる,大谷拓也,小林委加,田村真夏(大阪府立大学),Kubata, B. Kilunga(African Union/NEPAD, Kenya),井上勝晶,Rambo, P. Robert(Diamond Light Source, UK),内山 進,石井健太郎(大阪大学),西村重徳,乾 隆(大阪府立大学)
令和2年8月
大阪府立大学 生命環境科学研究科 教授
乾 隆














